
昨日Twitterで興味深いtweetを目にしました。
慶応大学と千葉大学の研究チームが、ナルコレプシーの患者さんの意見を収集して、治験計画に活かそうとしているのです。
これは「Patient Centricity:患者中心主義、患者さんの声を活かした医薬品開発」という、日本においては比較的新しい概念の動きの一つです。
私も概念は理解していましたが、実際の具体的な行動を見てきたわけではないので、このtweetは大変興味を引かれました。
今日は宣伝も兼ねて、このPatient Centricity(ペイシェントセントリシティー)について、簡単にまとめてみたいと思います。
参考に用いた資料は製薬協の発出している「患者の声を活かした医薬品開発 -製薬企業によるPatient Centricity-(2018年6月)」になります。
治験関係者の方は原文を読まれていると思いますので、今日の内容は業界外の患者さん向けの内容を意識して作成しました。
患者の声を活かした医薬品開発 -製薬企業によるPatient Centricity-|治験に関する医薬品評価委員会の成果物|日本製薬工業協会
Contents
Patient Centricityとは?
Patient Centricity とは「患者中心」を意味する概念のことです。
患者さんを取り巻く医療機関、規制当局、製薬企業の 3 者が「患者を常に中心に据え、患者に焦点をあてた対応を行い、最終的に患者本人の判断を最大限に尊重すること」とも言われております。
製薬協のタスクフォースではこの概念を踏まえた具体的な活動として「患者さんから直接またはその家族や患者団体を通じて入手した患者の声を企業活動に活かすこと」と考えています。
これまでの治験は企業や医師、規制当局の3者で動いており、医薬品の最終的な使用者が患者さんを蚊帳の外において実施されてきました。
その結果、治験参加が難しいようなスケジュールが組まれていたり、侵襲性のある検査が不要に多くなってしまったり、1日の実施項目が多くて負担をかけてしまうようなケースもありました。
Patient Centricity 活動は、患者さんの声や実体験を集めることで、患者さんにとって医薬品開発に自分の経験が活かされて社会貢献につながる、より参加しやすい治験が計画される、いち早く良い薬が使用できる可能性があるなどのメリットがあります。
また製薬企業にとっては医薬品開発に新たな視点を得ることにもつながるのです。
医薬品開発の流れにおけるPatient Centricity事例
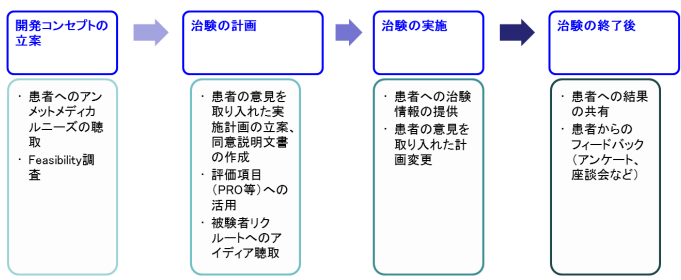
開発の流れに沿って、Patient Centricityの活動例を示したものが上記の図になります
欧米では既に複数の製薬企業が医薬品開発で Patient Centricity 活動を開始しております。
例えば、患者さんの意見を取り入れた治験デザインや同意説明文書の作成、患者さんによる直接評価である Patient Reported Outcome(PRO)の活用、患者さんへの治験の結果の共有、患者さんへの治験情報の提供などです。
欧米では患者団体の活動が活発であり、行政もそれを受け入れて積極的に行動しており、Patient Centricityの活動は日本とは比較にならないくらい進んでいます。
これを受けて日本においても外資系製薬会社については、この考え方がかなり浸透しており、実際に行動に移している企業も多いのではないかと思います。
内資系製薬会社も武田薬品工業を中心として、概念を打ち出して活動を進めている段階ではありますが、まだまだ外資と比べると弱い状況かなと、個人的には考えています。
日本と欧米の規制当局の動きの違い
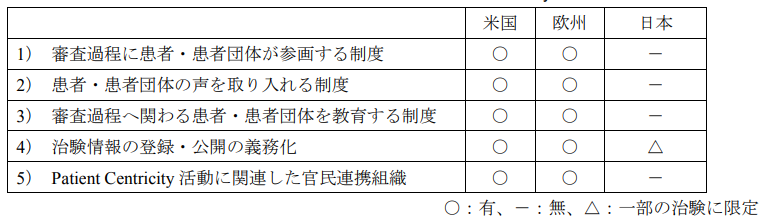
日米欧における規制当局の Patient Centricity 活動をまとめた表になります
欧米の規制当局はいずれも Patient Centricity 活動を積極的に実施しておりますが、日本では欧米の規制当局が実施しているような活動はほとんど実施されていないのが現状です。
日本と欧米の製薬会社の動きの違い
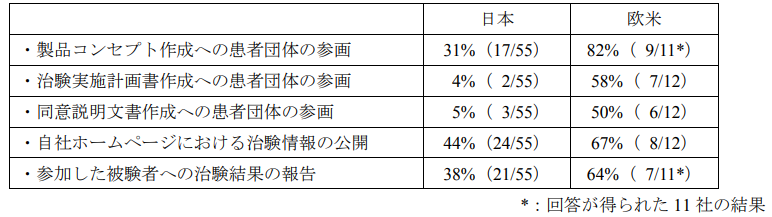
アンケート時点では、日本では Patient Centricity 活動を実施している製薬企業は半数に満たず、欧米と比較してもその割合は低い結果となりました。
特に治験実施計画書及び同意説明文書作成へ患者団体が参画する活動は、ほとんど行われていませんでした。
また、製品コンセプト作成への患者団体の参画も欧米では 82%と高かったのに対し、日本では 31%と大きく乖離していることが分かりました。
医薬品は「患者さんのもの」ではなく、使用する医師のものという考え方が少し残っているのではないでしょうか。
確かに売り上げに直結するのは医師がどれだけ処方してくれるかにかかっているわけですから、そこに注力することはある意味当たり前ですが、実際に使用する患者さんの視点を忘れては本末転倒ということですね。
この調査時点では、日本での製薬企業の医薬品開発において患者の声を活かす活動を開始している製薬企業も複数あるものの、欧米と比較してまだ多くはない結果でした。
一方で、96%の製薬企業が臨床開発段階における Patient Centricity 活動が重要であると回答しており、日本の製薬企業でも今後より具体的な活動が開始されることが期待されています。
日本における今後の具体的な活動例
今後の具体的な活動例をまとめてみました。
治験の実施概要の公開
日本語で治験の概要を分かりやすく説明して情報公開することです。
しかし後述のとおり、まずは治験という概念そのものの周知や理解が先な気がします。
治験参加患者さんへの結果の共有
私がよく活用しているようなJAPIC や Clinical Trials gov 等の公開サイトとは別に日本語で、かつ患者さんが理解できる平易な言葉で治験結果のまとめを作成し、治験に参加後に情報提供を希望する患者に共有することです。
せっかく治験に参加したのに、自分がプラセボ群だったのか、実薬群だったのかすら伝えられていないことがたくさんあるのではないかと思います。
患者さん個人の治験結果を作成し、情報提供を希望する患者に提供することも重要であると思います。
治験に関する啓発
日本では治験というものがいまだに一般的ではなく、誤解も多数見受けられます。
今回のアビガンやレムデシビルといったCOVID-19治療薬候補に関する世論を見ても明らかですね。
少し前に医療ドラマで治験参加している医師に対して、製薬会社から金銭提供している場面があったと聞きます。
脚本家やメディアの認識は化石レベルかと耳を疑った話ではありますが、裏を返せばそれだけ業界の周知や情報の公表が上手くいっていないということです。
メディアに期待するのではなく、業界自体がもっと積極的に治験というものを周知していくことが重要であると考えます。
治験の実施計画立案への患者の貢献
患者さん等の意見を聞き、治験に入ることの負担を軽減する計画を立案することです。
先に上げたように治験におけるスケジュールや採血項目、頻度など、実際に治験に参加する患者さんの意見を聞き入れることは重要ですね。
同意説明文書作成への患者参画及び同意取得の工夫
同意説明文書とは治験に参加する前に患者さんに治験のことや治験薬のことを説明し、治験に参加することやデータを活用すること、カルテを閲覧させていただくことなどを同意いただく重要な文書のことです。
この文書は患者さんが理解しやすいものでなければなりません。
そのため患者さん自身によるレビューを実施するのです。
また分かりやすいように補助説明ツールの作成なども検討していくことが挙げられます。
治験に参加した患者さんからのフィードバックの活用
治験終了後のアンケート、座談会を開催し、治験に参加した患者さんからフィードバックを得ることも重要と考えられています。
課題(私見)
さてPatient Centricityが重要かつ有用であることを述べてきましたが、実施する上での問題点を考えてみました。
あくまで私見であり、全てが業界団体の意見というわけではありません。
患者さんの意見にかかるバイアス
新しい治療や医薬品に興味がある患者さんは、新薬に過剰な期待を持っている可能性があります。
また逆に新薬は副作用が怖い等といった過剰な不安を持っている可能性もあります。
この片方に極まった意見が、客観的な意見をつぶしてしまう可能性もあります。
しかしある意味これは生の重要な意見なのかもしれません。
バイアスのかかった意見をどう捉えていくのかは今後の課題になるのではないかと思います。
治験という仕組みに対する理解不足/抵抗感
前述の治験の啓発部分でも記載しましたが、日本における治験の理解度は低い状況であると言わざるを得ません。
患者さんは、治験について医師や我々開発担当者と同じようには理解していないのです。当たり前ですが。
つまり見当違いな方向に意見が出てしまう可能性もあります。
例えば「治験をしないでも症例報告だけで承認を取れ!」とか。
まずは治験という仕組みの周知が大前提と思います。
治験計画への介入の度合い
治験では被験者の安全性を確保することは最も重要なことでありますし、患者さんの意見を取り入れて治験を進めていくことも重要であることは疑いありません。
一方で治験は科学的に客観的に妥当な結果を出すために計画されます。
患者さんの意見を受け入れるあまり、治験として成立しえないもの、成功できないような計画となってしまったら、結局は治験に参加した患者さんや新薬を待つ患者さんにとって、不利益となってしまいます。
介入の度合いは考えなければならないと思います。
Patient Centricityの良い事例と悪い事例
良い事例としてPatient Centricityの活動が治験実施にまで到達したタグリッソの事例をあげました。

悪い事例としてPatient Centricityを無視して、流通管理により患者さんに薬が届きにくくなったモディオダールの事例をあげました。

まとめ
今日はPatient Centricityについて考えてきました。
医薬品の開発は自分の知りえないところで行われていると考えがちですが、実はそんなことはなく、医薬品をみなさんで作り上げていく動きが加速しているのだ!ということを少しでも感じてもらえましたら幸いです。
また我々開発側もきちんと患者さんの視点に立って開発を進めていくことが重要であると改めて感じました。







