
先日、ギリアドの開発する期待のCOVID-19治療薬、レムデシビルの臨床試験情報をまとめさせて頂きましたが、一部の結果が公表されましたね。
併せてNIH(NIAID)主導の二重盲検試験の結果も公表されました。
今日はまずはギリアドのオープンラベルの臨床試験の結果を簡単に整理しつつ、内容について私見を述べさせていただこうかと思います。
NIHのほうはまた後日に気が向いたら記事にします!
本当は今日にしようかと思ったのですが、英語読むの疲れました。すみません。
なお今回のまとめは、専門的な議論はあまりせずに、試験の結果をみんなで把握してみようという趣旨です。
なるべく平易にしているとともに、深い議論は私には太刀打ちできませんのでご容赦くださいませ。
SIMPLE Study(ギリアドのオープンラベル試験)の概要
さて、まずは先日ご紹介したほうの臨床試験の結果から整理しましょう
試験概要は過去記事にまとめてありますので、そちらを参照ください。
簡単にまとめますと、重症例を対象として、患者さんを標準療法に加えレムデシビルを5日間または10日間上乗せして静注投与する群に割り付け、14日後の重症度を7段階の尺度で評価するオープンラベルの無作為化試験です
分かりにくいと思いますが「標準療法+レムデシビル10日連続投与」vs「標準療法+レムデシビルを5日遅らせて5日投与」です。
中等症のほうはレムデシビル非投与群もありますが、重症群では患者さんの安全性を考慮してか、設けられていませんね。
なおオープンラベルですので、薬を投与するDr.はレムデシビルを5日または10日上乗せしていることを認識しております。
臨床試験結果の概説
臨床試験結果に対するプレスリリースは下記のとおりです。
今回の結果はトップラインの結果であり、試験が全て完了した段階での結果ではないことにご注意ください。
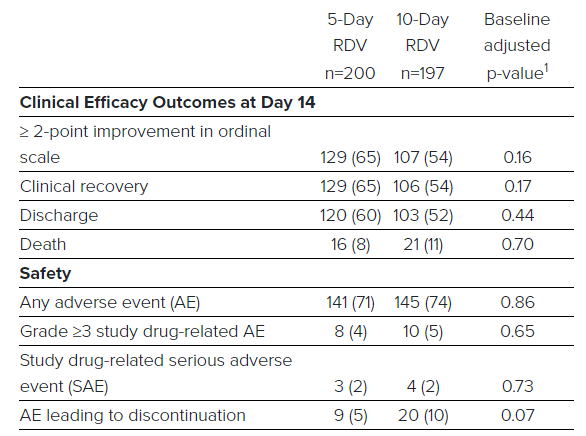
こちらが結果の概略図になります。
レムデシビル5日投与群と10日投与群では差は認められていません。
これは10日間投与群の結果が悪いということでしょうか。
そうではないのです。
ここで言えることは「10日間投与の結果が悪いのではなく、5日間投与で効果が得られる可能性があるということ」です。
つまり良い結果です。
5日間のレジメンで対処できれば、現在のレムデシビルの供給で治療できる患者の数を大幅に増やすことができます。
これはパンデミックの状況で特に重要であり、病院や医療従事者が緊急にケアを必要としている患者をより多く治療するのに役立つと考えられています。
ただし、肝心のレムデシビル非投与群のデータがないため、この試験の結果だけでは何とも言えず、NIHのほうの結果と併せて議論が必要な内容かと思います。
つまるところ結構前のめりな解釈ではあります。
(これだけ言っておいて中等症のExtension Studyで万が一負けたらまずいですね。。。)
有効性に関する結果の詳細と所感
もう少し詳しく結果を見ていきましょう。
この試験における「臨床的改善」の定義は「病院の退院や酸素サポートのレベルの増加等の定義済みの7ポイントの評価スケールにおける、ベースラインからの2ポイント以上の改善として定義されています。
この7ポイントの詳細は先日解説した下記になります。
- Death
- Hospitalized, on invasive mechanical ventilation or Extracorporeal Membrane Oxygenation (ECMO)
※侵襲的換気措置(気管支挿管)やECMOによる入院
- Hospitalized, on non-invasive ventilation or high flow oxygen devices
※非侵襲換気措置や高流量酸素装置による入院
- Hospitalized, requiring low flow supplemental oxygen
※低流量酸素装置による入院
- Hospitalized, not requiring supplemental oxygen – requiring ongoing medical care (coronavirus (COVID-19) related or otherwise)
※酸素の補助を必要としない継続的な医療措置が必要な入院
- Hospitalized, not requiring supplemental oxygen – no longer required ongoing medical care (other than per protocol Remdesivir administration
※酸素の補充を必要とせず、継続的な医療措置も必要ない入院
- Not hospitalized.
※退院
また臨床的回復(Clinical Recovery)の定義は、酸素サポートが不要になった場合、または病院から退院した場合と定義しています。
では結果について見ていきます。
患者の50%の臨床的改善までの時間は下記のとおりです。
・5日間投与群:10日
・10日間投与群:11日
両治療群の14日目までの退院した患者の割合は下記のとおりです。
・5日間投与群の退院 :60.0% n = 120/200例
・10日間投与群の退院:52.3% n = 103/197例
14日目における臨床的回復は下記のとおりです。
・5日間投与群の患者の64.5%(n = 129/200例)
・10日間投与群の患者の53.8%(n = 106/197例)
探索的分析結果の概説と所感
症状が発現してから10日以内にレムデシビルを投与された患者は、症状発現して10日以上後に治療された患者と比較して転帰が改善しました。
14日目までに、治療群全体のデータを統合すると、早期にレムデシビルを投与された患者の62%が退院し、遅れてレムデシビルを投与された患者では49%が退院したということです。
つまり発症初期の投与のほうがより有効であるということです。
レムデシビルは抗ウイルス薬であり、RNAポリメラーゼの阻害によりウイルスの増殖を抑えます。
この結果は作用機序の観点からも納得できる結果だと考えています。
安全性に関する結果
5日間と10日間の両方の治療群で忍容性が良好な結果となっています。
10%以上で発生した有害事象は、下記のとおりです。
・悪心(5日:10.0%、10日:8.6%)※気持ち悪いという状態です
・急性呼吸不全(5日:6.0%、10日:10.7%)
なお懸念されていた「グレード3以上の肝酵素(ALT)の上昇」は7.3%の患者で発生し、3.0%の患者は肝臓関連の検査値上昇のためにレムデシビル治療を中止しました。
レムデシビルの肝機能に与える影響は注意するべきではありますね。
まとめ
ギリアド社の実施するオープンラベル試験の結果は総じて良好であったといえるかと思います。
今後数週間以内に査読付きのジャーナルに掲載するために完全となるデータを提出するとのことです。
このまま進めば承認されるでしょう。
待望されたCOVID-19治療薬の第1号ですね!
一方でNIHの試験結果では良好ではありましたが、回復の期間短縮が(11日vs15日:31%短縮)で有意差があったたものの、亡くなった方の割合は有意差がつかずと、有用性は示唆されたものの「切れ味はそこまでよくない結果」となっています。
発症初期での投与がより有効であることが示唆されておりますし、詳細な解析が行われれば、特定の患者群での有用性があきらかになるかもしれません。
今回は重症例対象でしたが、作用機序を考えると中等症のほうが効果的となる可能性もあります。
現在実施中の中等症の試験(レムデシビル非投与群もあり)も恐らく成功すると見込まれますが、その結果を受けて、この薬の使い方というものも検討が必要でしょう。
承認はされるでしょうが、これだけで特効薬と考えてはいけません。
これで全て解決と考えるのは時期尚早です。
我々はこの結果に喜びつつも、COVID-19を抑え込むために行動を継続していかなければなりませんね。
5/2追記
FDAがCOVID-19に対するギリアドのレムデシビルを緊急使用承認しました!
NIH(NIAID)のACT試験(次の記事)とギリアドのSIMPLE試験(本記事)の結果に基づき、適応は入院中重症例(SpO2 94%以下で、酸素、人工呼吸器もしくはECMOが必要とされる場合)のみです。
中等症の試験が終われば、使える人も増えるでしょう!
取り敢えずはよかったですねー!
おまけ
あ、ギリアドの株買おうと思っていたのですが、アメリカ株の買い方が分からずに買っていませんでした。
買おうと思った時から15%ぐらい上がっていますね。
こんなに応援しているのにね。私。
ということでポジトークではなく客観的に記載しております。
プレスリリースをまとめた感じですので、どちらかというとギリアド寄りではありますけどね。
アンジェスも記事にしたときの何倍かな?
あちらは医薬品開発担当者としては全力で応援していますが、個人投資家としては氷の眼で見ています。
NIH試験はこちら
※当ブログにおける見解は個人的見解であり、所属する企業の見解ではございません。また特定の銘柄の購入を推奨するものではありません。







