先日、藤田医科大学からプレスリリースされ、各メディアにも取り上げられましたが、アビガンの特定臨床研究の結果が出ましたね。
有効性について統計学的な有意差がつかずに、結果は失敗です。
「有効な可能性」なんて、負け惜しみを言われていますが、そんなこと言ったらなんでも「有効な可能性」はありますね。
そもそもそんなレベルの結果ではありません。
対象患者、目的、サンプル数をみてもいまいち何をしたかったのかよく分かりませんが、その辺りも踏まえて結果を整理してみましょう。
(※この試験が計画されたのは2月頃かもしれませんので、その時の情報量の少なさについては、考慮するべきかもしれません。)
試験概要
試験課題名
SARS-CoV2感染無症状・軽症患者におけるウイルス量低減効果の検討を目的としたファビピラビルの多施設非盲検ランダム化臨床試験
「対象は無症状/軽症患者」であり、アビガンを投与してウイルス量が減るかを見よう!!という試験です。
「多施設」ということは藤田医科大学以外にも多くの医療機関(47施設)が参加しているということ
「非盲検」ということは、医師は投与する薬が何であるか分かるということ(バイアスがかかる)
「ランダム化試験」ということは、割り付け(どちらの群になるか)は無作為ということです(これはいいこと!)
ここでの突っ込みどころは「対象患者の無茶ぶり」と、「主要評価項目の無茶ぶり」、「非盲検」であることでしょうか。
あれ?この試験何がしたかったんだ?
なお「特定臨床研究」とは、臨床研究のうち、次のいずれかに該当するものをいいます。
・企業からの資金提供を受けて実施する臨床研究
・未承認・適応外の医薬品等を用いる臨床研究
今回は下かな?
患者数
組み入れ患者数は89名です。少ない。
44名がアビガンの通常投与群(1日目から内服)、45名が遅延投与群(6日目から内服)に無作為割り付けされました。
片方ははじめからアビガンを飲んで、もう一方は6日目からアビガンを飲み始めるということです。
遅延投与群の1名は治験辞退したため、両群は44名でちょうど同じ数ですね。
ここでの突っ込みどころは「この数でなぜ勝てると思った」のか?
よほど切れ味がなければこのサンプルサイズで有意差を出すことなど不可能でしょう。
(国内で患者数が稼げない実情はありました)
しかし残念(あくまで試験上)なのはここからで、この研究参加時点で既にウイルスが消失していたことが判明した方が19名もいました。
結果、通常投与群36名、遅延投与群33名での解析となりました。
たかだか19名減っただけじゃん!と侮ることなかれ。
割合にして約2割減です。
1,000名組み入れたところ、800名になっちゃったよー!と同じレベルです。
ただでさえ少ない患者数がこれでは厳しいですね。
結果と考察
主要評価項目
主要評価項目は「6日目まで(遅延投与群が内服を開始するまで)の累積ウイルス消失率」でした。
遅延投与群は6日目からアビガンを投与開始するということなので、アビガン投与群と未服薬群との比較ということですね。
この点はよいデザインと言えるかもしれません。
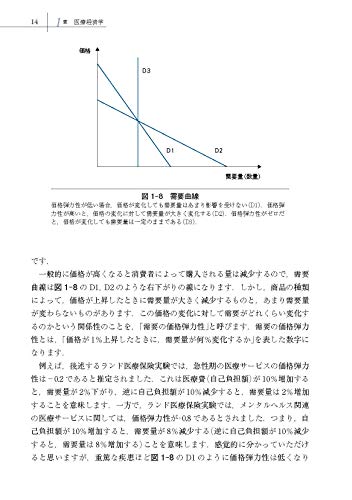
累積ウイルス消失率の結果は、「通常投与群で66.7%、遅延投与群で56.1%、調整後ハザード比は1.42(95%信頼区間=0.76-2.62、P値=0.269)」でした。
P値0.269ということは「お話にならないレベル」と考えて差し支えありません。
P値は低いほど優れています。
多少語弊がある表現ですが、砂糖を飲んでもらっても4回に1回は同じ結果が出るのと同じようなことです。
通常はP値が0.05、0.01、0.001辺りで設定して、その値を下回れば統計学的有意差があるということになります。
P=0.269というのは「有効性な可能性がある」とか言うレベルではないのです。
合格点が80点で、78点だったー!あと少しだったー。
もっと勉強していれば受かっていた可能性があったのにー!ではなく
「30点しかとれなかったけど、私は受かっていた可能性がある!!」と言っているようなものです。
まぁ可能性は0ではないかもですね。可能性はね。
仮に統計学的有意差が出たとしても、切れ味鈍すぎますね。
ちなみにハザード比とは、アウトカムが発生する割合を示す相対的な指標です。
ハザード比が1.5の場合、リスクが50%上昇することを意味しています。
今回でいればアビガン投与でウイルス消失というアウトカムが42%増えるということです。
ただし統計学的有意差が出ていないので、これは絵空事です。
副次評価項目
副次評価項目は「6日目までのウイルス量対数値50%減少割合」でした。
結果は「通常投与群で94.4%、遅延投与群で78.8%、調整後オッズ比は4.75(95%信頼区間=0.88-25.76、P値=0.071)」でした
こちらでも負けましたね。
ちなみにオッズ比とは、事象の起こりやすさを比較したものですね。
詳しい解説は他所に譲ります。
探索的評価項目
探索的評価項目は「37.5℃未満への解熱までの平均時間」でした。
結果は「通常投与群で2.1日、遅延投与群で3.2日、調整後ハザード比は1.88(95%信頼区間=0.81-4.35、P値=0.141)」です。
こちらも綺麗に負けました。
特にいうことはありません。
有効性については全敗です。
安全性
有害事象としては、血中尿酸値の上昇が84.1%、血中トリグリセリド値の上昇が11.0%、肝ALTの上昇が8.5%、肝ASTの上昇(いずれも検査値異常)が4.9%に見られました。
これらの異常値は、内服終了後(16日目または28日目)に再度採血された患者(38例)のほぼ全員で平常値まで回復していることが確認されました。
また、痛風を発症した患者はいませんでした
以前審査報告書の記事でも考察しましたが、これらの有害事象は想定される範囲ですね。
ちなみに尿酸値上昇はアビガン及び代謝物であるM1がOAT1及びOAT3 を阻害することによる尿酸の尿細管分泌抑制、及びM1 のURAT1 を介しての尿酸再吸収亢進が起こり、尿酸排出能が低下することによるものと考えられていますね。
まとめると「予想される有害事象は認められたけど、投与後には戻ったよー!」ということです。
しかし、アビガンの最も憂慮される有害事象である催奇形成については、この試験では関係ないので触れられていません。
この点は忘れてはならない点ですね。
結果のまとめ
まとめると「有効性は統計学的には全く認められなかったけど、有害事象はちゃんと予想されたものが出たよー!でも投与後消えたから安心してね?」っていう感じの結果ですね。
うーん、これ飲んじゃダメなやつでは?
というか催奇形成という爆弾もお持ちなわけです。
臨床試験結果がまだですが、少なくとも今回の試験はアビガンに泥を塗った形となりましたね。
試験を担当した土井教授は、「レムデシビルの回復までの時間に関するハザード比は1.3だった、レムデシビルは1,000人以上組み入れたからと有意差が出た」と述べています。
まるでハザード比が1.4のアビガンがレムデシビルよりも優れているように言いたげですが、アビガンは統計学的有意差が出ていないので、1.4という数字に意味など皆無です。
比較対象にすらなり得ません。
どうすればよかったのか?
今回のアビガンの試験の結果は惨敗です。
でも、アビガンが悪いというよりかは、このデザインではそうなりますよねー。という結果だと思います。
正直このデザインで勝てる薬があるとは思えません(私見)。
それこそスペシャル特効薬ですね。
じゃあどうすればよかったのでしょう?
突っ込みどころが多い試験ではありますが、主要評価項目や大枠のデザインを変えない前提で私見を述べます。(根拠のない感想です)
対象患者の検討
今回の対象患者は無症状/軽症患者です。
症状とウイルス量がどのように相関するのか分かりませんが、試験開始時点で2割の患者がウイルスが消失していた点を考えるとこの対象患者は失敗でしょう。
結果論だと思いますか?
そもそも8割が自然寛解する疾患なわけです。
無症状や軽症患者でウイルス量が十分にない可能性は考慮しておくべきだったでしょう。
つまり今回は(今回も)中等症~重症患者を対象にするのが必要だったと思います。
それができなかったのは、中等症~重症の患者があまりいなかったからかもしれません。
だからといって、勝てない試験を強行するのは、参加する患者さんや携わる医療従事者にとって失礼な話ですね。
勝てそうにないなら勝てるように変えればよいのです。
例えば海外も含めたデザインにするとか。
それができないなた実施するべきではありません。
臨床試験の「対象集団というのは、試験目的に対応するように選択されなければならない」のです。
サンプルサイズの検討
今回は100名にも満たない試験でした。
サンプルサイズは中止や脱落等も踏まえて、統計学的有意差が出せるように綿密に考えられて決めていきます。
サンプルサイズが不要に大きいと試験に時間がかかりますし、小さいと統計学的有意差を出すことが難しくなります。
この試験はきちんと考えて設計していたのでしょうか?
国内の患者数が少ないことは分かりますが、そうであれば実施するべきではない、もしくは前述のとおり、海外との共同研究にするべきでしたね。
正直、このサンプルサイズでこの目的でアビガンで有意差を出そうなどと思ったということは、大して考えられていないのではないかと疑ってしまいます。
臨床試験は、「一定の精度を保ち、誤った結論を下す確率を制御することにより、得られた知見に基づいて統計学的結論を下すのに十分な数の被験者を含むように計画する必要がある」のです。
まとめ
今日はアビガンの特定臨床研究について、考察してきました。
こないだの観察研究もそうですが、無駄な(と思われる)試験が多すぎます。
COVID-19の患者数は限られているのです。
個々の医療機関やアカデミアが、治療薬の探索にまい進するのは止められませんし、その熱意は素晴らしいものですが、結果として失敗にならないように、統括していく必要があったのではないかと思います。
ただ試験を計画した時期が2月頃と考えると、情報が少なく、この試験がイケてないことを攻めすぎるのは酷な話なのかもしれませんね。
アビガンの臨床試験結果はこれからとなりますが、あまりサンプル数は多くありません。
この切れ味であのサンプル数では、結果を出すのは難しいかもしれません。
皮肉にも私にはそんな考えを後押しする試験となりました。
しかし臨床試験で有意差が出せれば、この臨床研究の失敗は覆せるでしょう。
まだチャンスはあるということです。
ただし現状、無作為化臨床試験で有効性は認められていないのは揺るがない事実です。
参考
・藤田医科大学のプレスリリース
ファビピラビル(アビガン)特定臨床研究の最終報告について | 藤田医科大学 – Fujita Health University
・アビガンの臨床試験概要
どんな試験か見てみましょ?アビガンの国内第3相臨床試験開始、試験概要と用語の解説(富士フイルム)
・アビガンの審査報告書と催奇形性のお話
【COVID-19】アビガンの審査報告書を読んで、催奇形性の副作用について考えよう!【コロナ】
・サリドマイドのお話
【アビガン】サリドマイドにおける催奇形性の薬害の教訓と対策は活かせるか?
・COVID-19治療薬の開発を振り返って
【限られた患者数】COVID-19治療薬開発競争を振り返って思うこと【市場/リソース】
※当ブログにおける見解は個人的見解であり、所属する企業の見解ではございません。また特定の銘柄の購入を推奨するものではありません。