
前に医療技術評価(HTA)が薬価に反映されるかも?とか、特例市場拡大再算定制度でオプジーボの薬価が半値にされた!なんてお話をしましたが、肝心の薬価算定制度のお話をしていませんでしたね。
ややこしい話なのですが、結構ご質問頂くことも多いので、今回取り上げてみたいと思います。
今日取り扱うのは新医薬品の薬価算定のお話です。
数々の関門を通り抜け、承認までこぎつけた医薬品のルーキーにどうやって薬価をつけられるのか?
その3つの道筋を見ていきましょう。
Contents
新医薬品の薬価算定に至るまでの3つの道筋
規制当局の資料を参考に新医薬品の薬価算定に至るまでの流れを図示してみました。
Excelで模式図を作成するという人によっては怒りそうなやり方で作りました。
だってこっちのが簡単なんだもん!
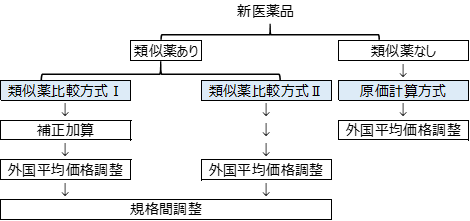
新医薬品の薬価算定までの道筋は大きく3つあります。
まずは類似薬があるかないかで大きく変わります。
類似薬がある場合は「類似薬比較方式ⅠとⅡ」があります。
Ⅱというのは新規性が乏しい医薬品が分類される区分です。
つまりⅡに分類されてしまうと、かなり薬価が抑制されてしまうということです。
昔は「ゾロ新」といったちょっと側鎖を変えただけの新医薬品と呼んでいいのか微妙なものが多かったですが、今はそういう薬は評価されないようになっているということですね。
これまでにないようなそのカテゴリーで初めてとなるような薬は「原価計算方式」で計算されます。
これがだいたい一番高くなりやすいですね。
何となくイメージ通りかと思います。
イノベーションは評価されなきゃですよね。
類似薬比較方式でもゾルゲンスマのような高額がつくこともあります。
気が向いたら別途取り上げます。
ではそれぞれの算定方式の内容を簡単にまとめてみましょう。
類似薬比較方式Ⅰ
同じ効果を持つ類似薬がある場合には、市場での公正な競争を確保する観点から、新薬の1日薬価を既存類似薬の1日薬価に合わせるというルールです。
ここでいう比較薬は、原則として薬価収載後10年以内の新薬であって後発品が薬価収載されていないものを用いるとされています。
例えば、既存薬Aが1錠50円で一日3回服薬の場合は1日薬価は150円ですね。
新薬が1日1錠で済むのであれば、新薬の薬価は150円になるということです。
類似薬の要件
類似薬とは、下記の項目で類似性があるものとされています。なかなか微妙なところです。
さてこれでは新規薬剤を開発しても類似薬だと微妙ですよね。
これに2つの分類の加算が加わります。
薬価の加算①
・画期性加算(70~120%)
いわゆる画期的な新薬の場合です。
というと身も蓋もありませんが、作用機序が新しかったり、有効性や安全性が優れている薬剤等の場合が該当します。
もう少し専門的に言うと下記のような要件となります。
全部満たさないと、画期性加算はもらえません。
・有用性加算Ⅰ(35~60%)
上記の画期性加算のうち、2要件を満たすものです。
満点ではないけど、サービスしちゃう感じですね!
・有用性加算Ⅱ(5~30%)
下記のいずれかを満たす新薬が該当します。
薬価の加算②
・市場性加算Ⅰ(10~20%)
希少疾患用医薬品であること、比較薬が市場性加算Ⅰを受けていないことなどが条件です。
希少疾患、つまり対象患者が少ない疾患については、売り上げが少なくなってしまうので、おまけするよー!ってことですね。ちょっと加算しただけでは医療経済的にも負荷は少ないわけです。
・市場性加算Ⅱ(5%)
主たる効果/効能が市場規模が小さいものであること、比較薬が市場性加算Ⅱを受けていないことなどが条件です。
希少疾患とまでいかなくても、市場規模が小さいならばおまけするよー!ってことですね。
・小児加算(5~20%)
用法用量に小児があること、比較薬が小児加算を受けていないことなどが条件です
小児の適応を取ることは難しいので(コスト面や安全性面などで治験が難しい)、頑張って適応取ったらおまけするよー!ってことですね。
・先駆け審査指定制度加算(10~20%)
治療方法/診断方法の画期性、対象疾患の重篤性、対象疾患に係る極めて高い有効性、世界に先駆けて日本で早期開発・申請する意思(同時申請も含む)
そんな条件を満たす医薬品は、先駆け審査指定制度の対象となることがあります。
これは申請にかかる時間を短縮することができる制度ですが、そうするとよく頑張ったね!ということでおまけしてもらえます。
類似薬比較方式Ⅱ
新規性に乏しい新薬については過去数年間の類似薬の薬価と比較して、もっとも低い価格とするという厳しいルールです。
ここに分類されると、控えめに言ってもかなり厳しいです。
「それ、開発の意味あるー?」って言われているようなものです。
何てことだ。もう、助からないぞ?
以下の条件をすべて満たすものになります。
似たような薬が昔からあるじゃーん!って感じですね。
これに該当すると原則として、①または②のいずれか低い額となります。
① 過去6年間に収載された類似薬の最も安い1日薬価
② 過去10年間に収載された類似薬の1日薬価の平均価格
この価格が③を超える場合は更に④⑤を計算し、③④⑤で最も低い額に下げられます。
③ 類似薬効比較方式Ⅰによる算定額
④ 過去10年間に収載された類似薬の最も安い1日薬価
⑤ 過去15 年間に収載された類似薬の1日薬価の平均価格
もうどうしようもないですね。これ。
原価計算方式
類似薬がない場合には、原材料費、製造経費等を積み上げていき、薬価を算定します。
例えば、原材料費、労務費、製造費、輸入原価、研究費、販売費、営業利益、流通経費、消費税等を勘案して決定します。
ここの研究費に基礎研究費や臨床試験費用、PMS費用などが含まれるわけです。
販売費の見込みについては、ざっくりした売り上げ予測を反映します。
別途資料を提示し、推定した売り上げの内容の妥当性についても検討されます。
外国平均価格調整について
類似薬効比較方式Ⅰ、原価計算方式のいずれの場合も、外国価格との乖離が大きい場合には、調整を行います。
ここでいう外国平均価格はアメリカ、イギリス、ドイツ、フランスの価格の平均額となります。
いわゆる先進国の価格を参照するということです。
調整対象要件は下記の2種類です
・外国平均価格の1.5倍を上回る場合→ 引下げ調整
・外国平均価格の0.75倍を下回る→引上げ調整
要は主要な先進国よりも費用の乖離が大きい場合にそれにすり合わせていきますよー!という調整です。
その他の関連制度
特例市場拡大再算定制度のお話
オプジーボの項目でご紹介させて頂きましたが、裏技で薬価を引き下げたお話です。
オプジーボ、夢の薬か金喰い虫か、高い薬価の変遷と特例市場拡大再算定制度(小野薬品:4528) – るなの株と医療ニュースメモ
オプジーボは類似薬がなかったので、原価計算方式で算定されました。
そして当初の対象も数百名の希少な疾患だったので、薬価が高くついたのですね。
(上記の販売費の部分が少なくなったので、その分薬価が高くついたのです。加算もありました。)
ところがその後の適応拡大で急速に市場規模が拡大し、大騒ぎとなった事例です。
医療技術評価(HTA)のお話
先日、医療技術評価の薬価への反映について、概要をお話しさせていただきました。
【薬価のお話】薬の承認はゴールではなくスタート!HTA(医療技術評価)の基本 – るなの株と医療ニュースメモ
こちらの薬価への反映の詳細はここでは触れないでおきます。
今日はあくまでベーシックなところに留めますね。
えっ?私がよく知らないだけではないかって?
・・・(目をそらす)
先駆け審査指定制度のお話
先駆け審査指定制度に指定された場合の加算について、ご説明しましたが、そもそもどんな制度なのかを概説した記事です。
そんなにいじめないで!「先駆け審査指定制度」と「ゾフルーザ」(塩野義製薬:4507) – るなの株と医療ニュースメモ
話題の超高額薬であるゾルゲンスマは、先駆け審査指定制度に指定されつつも、制度をうまく活用できていませんでしたが、それで加算がつくのはおかしいだなんて、中医協で叩かれていましたね。
まぁ分からなくもないですが、そんなにいじめなくてもよくない?
こうしてみると、これまでの記事で結構いろんな話してきましたね。
こうやって色々なところでつながってくると個人的には充実感あります。
いつか体系的にまとめてみたいですね。
まとめ
今日は薬価算定のベーシックな流れについて、ご紹介致しました。
以前も述べましたが、薬価は数円の差でも、それが直接利益につながるため、大変な利益の差をもたらします。
そのため、我々としては1円でも高い薬価をとるために躍起となるわけです。
このあたりの交渉に直接絡んだことはないのですが、大事な部分だと思います。
新しい薬を生み出すためには大きな時間的なコスト、金銭的なコストがかかります。
せっかく生み出しても特許が切れれば、それも終わりです。
いかに医薬品の価値を最大化していくかということも、製薬会社にとって重要な仕事というわけですね。
この医薬品のライフサイクルマネジメントについてもいつかお話ししてみたいとは思いますが、今日はこれぐらいにしておきますね。
この薬、たっかいなーと思ったら、どんな風に薬価が算出されているのか、類似薬の薬価はどれくらいなのかを調べてみると、面白いかもしれませんね!
今度ゾルゲンスマでも例に挙げて、事例を見ていきたいと思います。
薬価について、少しでも興味を持って頂けましたら嬉しいですー!
※当ブログにおける見解は個人的見解であり、所属する企業の見解ではございません。また特定の銘柄の購入を推奨するものではありません。







