
COVID-19によるパンデミックにおいて、日本のワクチン接種スピードは先進国でもトップクラスに早く、感染者数についても他国より抑えられております。
しかしその一方でワクチンの国内承認には後れを取りました。
これは海外で大規模な治験が行われ、有効性や安全性が確認されている状況下においても、国内での臨床試験を実施し、そのデータと併せて特例承認を取得していたためです。
言い方を変えれば、
特例承認制度は有効性/安全性の「確認」が承認の要件であることから、
「日本人での」有効性や安全性を確認する臨床データが不十分な場合には、その確認のために国内治験を追加で実施する必要があった、ということです。
この点において、医療関係者の中でも「もっと迅速に承認できたのではないか?」という声があがっていました。
下記の表を見れば、確かに国内試験が承認スピードに大きく影響を与えていたことは間違いないでしょう。
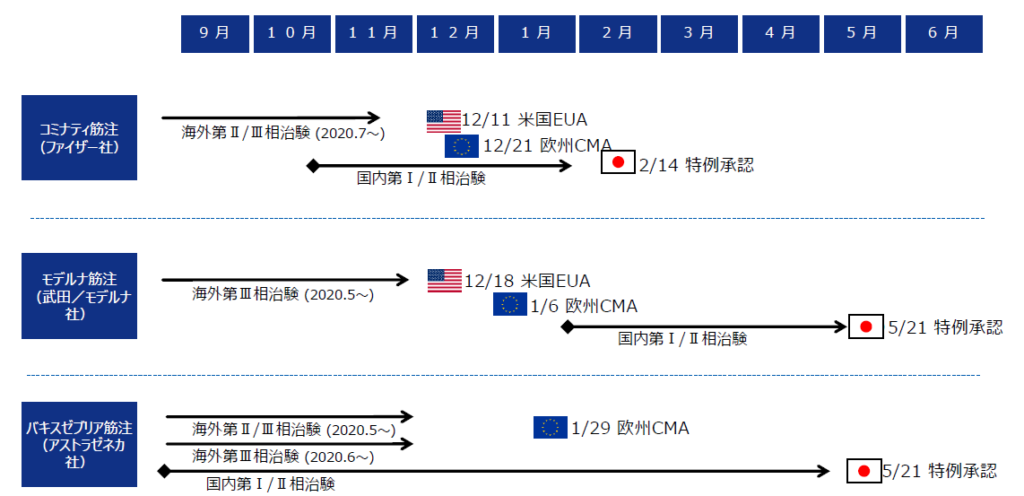
※令和3年12月3日医薬品医療機器制度部会 資料1より抜粋
そのような声を受けて、緊急時(主にパンデミックを想定)における薬事承認の在り方について、医薬品医療機器部会において協議がなされていますので、本日はその内容を少しご紹介させて頂きます。
なお私は本部会の関係者ではないことを、予め記載しておきます。
(ほんとだよ?)
あと前の記事から半年近くあいちゃってすみません。
特例承認の要件
まずは今回のパンデミックにおいて、活躍している特例承認について復習しましょう
特例承認については、下記記事で紹介しております。(外部サイト)
https://magazine.pha-net.jp/series/medical_news/report_08.html
この特例承認を得るためには海外での承認だけではなく、国内における試験データも提出しており、それが承認の遅延につながっていたというわけですね。
COVID-19ワクチン開発の考えの推移
続いて、COVID-19のワクチン開発に関するPMDAの提言について復習しましょう。
下記記事で紹介しております。


発症予防効果を見る大規模試験や既存ワクチンとの非劣性を確認するために、
国内での治験の必要性について記載があります。
このような考えを元に国内での試験を行ったうえで、申請をしているわけですね。
緊急時の新たな薬事承認制度(現時点の骨子から)
さて本題です。
緊急時の新たな薬事承認制度における考え方について、主な点をピックアップして、確認してみましょう。
発動要件
国民の生命及び健康に重大な影響を与えるおそれがある疾病のまん延、その他の健康被害の拡大を防止するために緊急に使用されることが必要な医薬品等であり、 他に代替手段が存在しないこと
どのような時にこの制度を適用しようか?ということです。
現在の特例承認と同様のものを想定しています。
いわゆるパンデミックや原子力事件、バイオテロ等ですね。
この点は特に異論ないかと思います。
気になるのは「他に代替手段が存在しない」という点です。
例えばワクチンでいえば、
1剤目は他に代替手段がないと言えますが、2剤目はそう言い切れるでしょうか?
作用機序が違う等があればまだ説明がつくかもしれませんが、そうでない場合は何とも言えないと思われるかもしれません。
しかし実は特例承認では、
対象の感染症の医薬品等がまだ存在しない場合だけでなく、薬事承認された医薬品等が既に存在したとしても、供給の面から対象としています。
今回のワクチンでいえば、ファイザーが承認された後も、その供給面も含めて同じような効果/作用機序を持つモデルナのワクチンも特例承認されましたね。
緊急時の薬事承認に関する制度においても、このような考え方をしていくものと想定されています。
認定の手続きについても、現時点では詳細は詰められていませんが、特例承認を想定して動いていますね。
運用の基準
有効性:推定
安全性:確認
どんな条件で承認しようかというところです。
これまでは有効性と安全性を「確認」していなければ承認できませんでしたが、有効性については「推定」で通せる形を想定しています。
ただし、こちらには期限や条件が付けられる予定です。
では有効性の「確認」「推定」とは何を意味しているのでしょうか?
ここでいう有効性の「確認」とは、モダリティや対象疾患によって変わるため一律には定められないものの、
一般的には、有効性があるかどうかを検証するため、事前に臨床的な有効性の評価基準(例えば、接種後の発症者数が有意に少ない)を設けて、その基準をクリアできるかどうかを確かめる臨床試験(検証的臨床試験)のデータを基にした評価をもって確認を行うもの(感染状況にもよるが、ワクチンの検証的臨床試験では、多数の被験者が必要なことが一般的)とされています。
一方で有効性の「推定」とは、
例えばワクチンの場合であれば、海外で行われた大規模な試験の結果を踏まえ 、日本国内での治験を行わなくとも、民族差や地域差を踏まえても、日本人に対する有効性が「一定の蓋然性をもって推定される」 ケースなどを想定しています。
今回でいえば、ファイザーやモデルナのワクチンは、海外での治験データをもって、有効性が「推定」されていると言えるでしょう。
なお治療薬の場合であれば、検証的臨床試験を踏まえた直接的なエビデンスが十分でなく、有効性が確認されるとまではいえないものの、入手可能なデータから、一定の蓋然性をもって有効性があることが推定されるケースが想定されています。
この辺りの感触は再生医療等製品でよく見られる条件付き/期限付き承認が近いのかもしれません。
条件/期限
必要な条件を付す(有効性等に関するデータの収集、保険衛生上必要な措置等)
承認の期限の付与。必要に応じ、承認の期限の延長が可能
さて、有効性が推定される段階で承認が得られるようにする方向ですが、これには条件と期限が付与される予定です。
有効性を「推定」で承認を行う緊急時の承認であるため、承認後も企業に検証データを収集させ、一定期間内に改めて承認申請させようということです。
また、改めて承認申請を行う際は、
承認時までに提出を猶予された試験(検証的臨床試験、日本人データ)等の成績に加え、使用成績調査等のリアルワールドデータ等により有効性等のエビデンスを提示させることが検討されています。
この検証の結果によっては、当然承認取り下げということもあり得ます。
また期限については、その医薬品やワクチンが必要とされる感染症拡大時等の緊急時の間は、有効である必要があるとされています。
パンデミックの途中に「はい、おしまい!」では困りますものね。
期間としてはスペイン風邪(2-3年)やインフルエンザ(1年)を踏まえて、2年程度が想定されているようです。
また必要に応じて延長は可能とする予定です。
考察/まとめ
本制度はまだ固まっていませんが、今回のパンデミック化における薬事承認制度への不満や医療現場における要望、ワクチン承認遅延による公衆衛生上の懸念をくみ上げた柔軟な制度になるかなーと個人的には思っています。
有効性の推定段階での承認というところに懸念が残りますが、海外での大規模試験が行われており、人種差が少ないワクチンであれば、この懸念は払しょくできると言っても過言ではないでしょう。
条件付き/期限付き承認が行われている再生医療等製品でも、通常の医薬品の第2相試験から第3相試験の流れでもそうですが、やはり少人数の試験での有効性の推定は、後で覆されるケースがままあると考えます。
国内・海外問わずに、数十人の治験で有効性や安全性が認められたからといって、パンデミック化においても大多数の患者さんに使用するのは慎重であるべきかなと思います。
承認取り下げは可能ですが、
じゃあ効かなかったから取り下げればいいじゃん!というわけにはいきません。
その間に他に有用な治療薬がなかったとしても、効果の少ない、効果のない医薬品を使用することは、金銭的にも副作用を踏まえた安全性の面からも良くないことです。
藁にすがる形で、結果的に効果があったらよいということに甘んじてはならないと思います。
有効性の「推定」というところをどのように取り扱っていくのかが、この制度を運用していくうえで非常に重要かつ議論が必要になる点ではないでしょうか?
みなさんはどう考えますか?
今回のパンデミックで浮かんできた様々な課題や問題点。
きちんと次につなげられるように、官民問わずに考えていきたいですね!
参考資料
令和3年12月3日医薬品医療機器制度部会 資料1









