
連日ワクチンネタばかり取り上げていますので、今日は比較的マイナーな治療薬について取り上げてみようと思います。
2021年6月現在、日本ではレムデシビル、デキサメタゾン、そして今日ご紹介する「バリシチニブ」(製品名:オルミエント)が、COVID-19に対して適応を取得しています。
レムデシビルは昨年取り上げましたし、デキサメタゾンは有名なステロイドということでご存じの方も多いでしょう。
一方でオルミエントは比較的新しいお薬ということでご存じない方もおられるかもしれません。
そしてオルミエントの適応は「SARS-CoV-2 による肺炎(ただし、酸素吸入を要する患者に限る)」という限定されたものになります。
なぜ酸素吸入を要する患者に限られているのか?
いったいどれほどの効果があったのか?
そんな疑問を審査報告書をもとに読み解いてみましょう
その中でCOVID-19治療薬開発の難しさについて感じていただければと思います。
また本剤の承認に至るまでの「日本人での検討の有無」というところも注目される点となりますので、併せて考えてみたいと思います。
本日の内容は審査報告書を参考に記載しておりますが、例によって専門的な記載はある程度丸めさせていただいています。
気になる方は審査報告書を直接ご覧ください。
PMDAのホームページで誰でも無料で閲覧できます。
また今回は丸めているとはいえ、前回のワクチンの不妊デマの記事と比べると、かなり難解と思われます。
その辺もご了承ください。
オルミエントの概要(どんなお薬?)
オルミエントはアメリカのIncyte 社が創製した、ヤヌスキナーゼ(JAK)阻害剤です。
日本では、2017年7月に「既存治療で効果不十分な関節リウマチ(関節の構造的損傷の防止を含む)」の効能・効果で承認され、
2020年12月に「アトピー性皮膚炎に係る効能・効果」が追加承認されています。
JAKはキナーゼということで、文字通り酵素のことです。
酵素は代謝を助けるタンパク質のことですね。
雑にいえば、酵素の働きを抑えることで、反応を抑え、その先の物質による影響を抑えることができます。
JAKは免疫に関係している酵素であり、このJAKを阻害することで、免疫反応に関わるサイトカインの働きを抑え、関節リウマチやアトピーの症状を抑えるというお薬です。
では「なぜリウマチやアトピーの薬が、COVID-19治療に用いられるようになったのか?」ということですが、
サイトカインストーム、いわゆる免疫の暴走がCOVID-19の重症化や、COVID-19に起因して亡くなる原因になっているという説があったためです。
免疫反応にかかわるサイトカインを抑えることで、COVID-19の重症化が防げるのではないか?
と考えられたのですね。
もう少し詳しく述べると、IL-6 等の炎症性サイトカインのシグナル伝達に関与するJAK-STATシグナル伝達経路を阻害する薬剤であることが、COVID-19治療薬候補として、注目されたということです。
上記を踏まえて、オルミエントはアメリカにおける医師主導治験が実施され、その結果をもとにCOVID-19に対する有効性と安全性が見いだされ、追加で適応を取得するに至ったのです。
ちなみに先般、アメリカで緊急使用許可を得た中外(ロッシュ)のアクテムラも、免疫に作用するという観点では似たようなものですね。
作用機序に関する考察(JAK以外に作用するのか?)
さて今回の話題はやや難解であるため、ここまで読み進められた方はなかなかいないのではないか?と思います。
ここまで読んだということは、それなりに忍耐力か知識のある方ということで、少々レベルが上がりますがご了承ください。
有効性について知りたい方は読み飛ばしても構いません。
本剤はJAK阻害剤であり、炎症性サイトカインのシグナル伝達を阻害することで、COVID-19に対して効果があると想定されて開発が進められていましたが、作用機序として想定されるものが実はもう一つあります。
それは「SARS-CoV-2 のエンドサイトーシスを促進するNAK ファミリー(NAKs)の阻害活性」です。
SARS-CoV-2 は「NAKs に依存したACE2 受容体介在性エンドサイトーシス」によって宿主細胞内に取り込まれて増殖すると考えられております。
つまり、NAKsを阻害するということは、
本薬の NAKs(AAK1、BIKE、GAK 及びSTK16)に対する親和性がキナーゼアッセイにより検討されており、AAK1、BIKE、GAK 及びSTK16 に対する本薬のKd 値はそれぞれ8.2、20、120 及び1,100 nmol/Lでした。
また、ヒト初代肝細胞を用いた3 次元器官培養法によりSARS-CoV-2 をIFN-α2 と培養したとき、SARSCoV-2 の受容体であるACE2 及びSARS-CoV-2 のヌクレオカプシドタンパクの発現上昇が認められ、本薬(100 nmol/L)の添加によりそれらの発現が抑制されています
しかしながら後述の臨床試験ACTT-2 試験では、本薬によるJAK-STAT 経路の阻害作用とNAKs阻害作用を区別して評価することは困難であり、
また、当該試験は抗ウイルス薬であるレムデシビルを併用していることから、本薬のウイルス増殖抑制効果を正確に評価することは困難であると考えられています。
詳細の検討も上記のin vitro(試験管内)の試験でとどまっており、
この作用機序が効果に影響を及ぼしている可能性は考えられるとはいえ、
結局よく分からないというところが、申請者とPMDAの結論ですね。
非臨床試験
非臨床試験については細かく触れませんが、今回の申請は既に別の適応で承認を取得しており、今回は新効能及び新用量であるということであり、多くの試験が省略されております。
例えば非臨床薬理試験は初回承認時に評価済みということで、新たな試験成績は提出されていないのです。
有効性(限定された適応)
では本題となる有効性に関する試験成績についてみてみましょう。
Keyとなる試験は、ACTT-2です。
これは聞いたことがある方もおられるでしょう。
そうです。レムデシビルの時にも出てきた試験ですね。
ACTT-2は、アメリカNIAID(米国国立アレルギー・感染症研究所)による医師主導治験(18 歳以上のSARS-CoV-2 による感染症患者を対象としたレムデシビル併用下における本剤の有効性及び安全性を検討することを目的としたプラセボ対照無作為化二重盲検並行群間比較試験)であり、
国際共同治験として2020年5月より開始され、日本からも試験に参加しています。
この試験結果を根拠として、イーライリリーより製造販売承認事項一部変更承認申請が行われているのです。
「日本からも試験に参加している。」
この部分は注意が必要な部分であり、本稿における議論のポイントの一つでもあります。
ちょっと覚えておいてください。
試験概要
さてACTT-2ですが2020年5月~2020年7月にかけて実施されていました。
対象は18 歳以上のSARS-CoV-2 による感染症患者[目標例数1,032 例)(各群516 例)]でして、
レムデシビル併用下におけるオルミエントの有効性及び安全性を検討することを目的とした、プラセボ対照無作為化二重盲検並行群間比較試験です。
日本、米国、シンガポール、韓国、メキシコ、スペイン、英国、デンマークの8カ国78施設が参加しています。
詳細な選択/除外基準は省略いたしますが、COVID-19で入院している、比較的症状が重めな方が対象となっております。
用法・用量は、レムデシビル併用下において、本剤4 mgまたはプラセボを1日1回、最長14 日間経口投与となります。
レムデシビルは、1 日目に200mg を、2~10 日目に100mg を1日1回静脈内投与しています。
なお、本剤、プラセボ又はレムデシビルのいずれについても、退院した場合は投与を中止することとされました。
重い症状を持つCOVID-19の方を対象としていますので、ベースとなる治療なしにプラセボを乗せるのは、倫理的にも難しい側面があるためであると思います。
有効性の概要
有効性について、本試験の主要評価項目は、無作為化後28 日時点までの回復までの期間と設定されています。
副次評価項目として無作為化後14 日時点でのNIAID-OS に基づく臨床状態が設定されていた。
NIAID-OSのスコア分類は下記のとおりです。

このように状態をスコア化しているのですね。
見てのとおりスコアが大きいほど、状態としては良くないというのが分かりますね。
このスコアは副次評価項目としても重要ですが、後述の適応を考える上でも重要となります。
結果についてみてみましょう。
ACTT-2 試験において、主要評価項目とされた無作為化後28 日時点までの回復までの期間についての結果が下記の通りとなります。
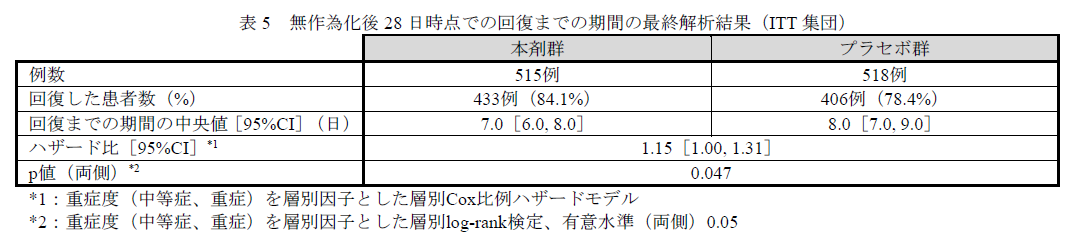
オルミエント投与により、回復までの期間が1日短縮しており、プラセボ群に対する本剤群の優越性が示されています。
(ハザード比[95%CI]:1.15[1.00~1.31]、層別log-rank 検定、p〔両側〕=0.047、有意水準〔両側〕0.05)。
そもそもこの薬剤は抗ウイルス薬ではなく、投与によってウイルスが消えたので解決!というような薬剤ではありません。
メインとなるのはJAK阻害によるサイトカインの抑制であり、特効薬を想定していないのです。
そのため、別にダメな結果というわけではありません。
しかしそれを差し置いたとしても、この結果、手放しに喜んではいけません。
重症度に基づいて層別したNIAID-OS 別の結果をお示ししましょう。
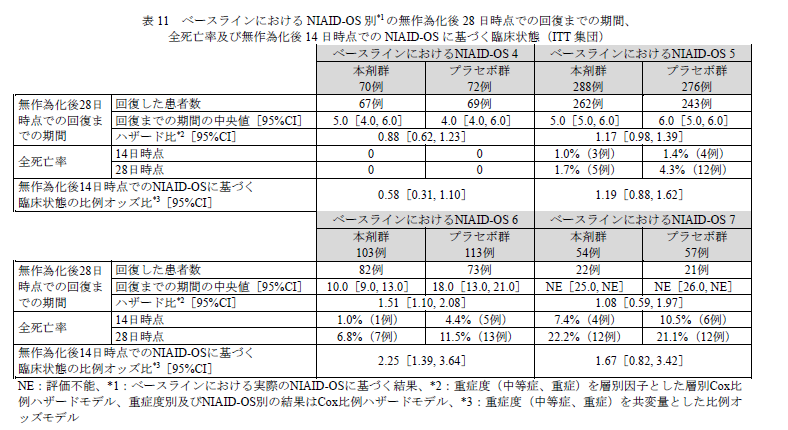
回復までの期間を見ればわかりやすいでしょう。
上記を見ればわかる通り、「ベースラインにおけるNIAID-OS 4の患者集団ではレムデシビルに対する本剤の上乗せ効果は確認されなかった」のです。
NIAID-OSのスコア分類については上に貼りました。
スコア4というのは、「入院中であるが酸素吸入は不要、治療の継続を必要とする」状態です。
この状態より軽いと、効果がないと推定されます。
もう少し視覚的にわかりやすいものをお示ししましょう。
カプランマイヤー曲線です。
カプランマイヤー法とは、アウトカムが発生するまでの時間を解析する方法のことです。
よく抗がん剤の生存時間を見るときに用いられますが、別にアウトカムは生存時間に限りません。
こちらは全体のものです。
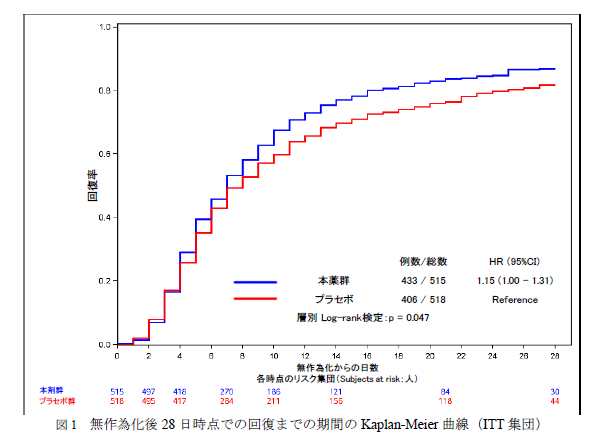
青色の実薬群がプラセボより回復率が高いのが分かりますね?
次に層別解析した結果を抜粋します。
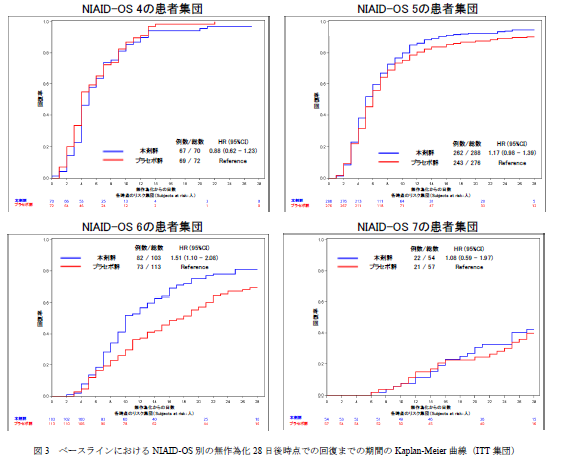
小さくて見えない?
スコア4だけ青と赤が逆転(重なっている)していることが分かれば十分です。
この結果から、
NIAID-OS 4はダメだったけど、「NIAID-OS 5~7 に相当する酸素吸入を要するSARS-CoV-2 による肺炎患者に対する治療選択肢の一つとなり得る」ということができます。
これを踏まえて、本剤の効能・効果は「SARS-CoV-2 による肺炎(ただし、酸素吸入を要する患者に限る)」と設定することになったのですね!
なお、ACTT-2 試験では、COVID-19以外の治療を目的とした副腎皮質ステロイド剤は使用可能とされ、
SARS-CoV-2 による感染症に対する標準治療として各国のガイドライン等で定められていた場合には生物製剤及びSARS-CoV-2 による感染症の治療を目的とした治験薬(市販薬剤の適応外使用を含む)の使用も可能でした。
本件について、これら本剤の有効性評価に影響を及ぼす可能性のある薬剤(Medicationof interest)を使用した患者について、
当該薬剤を使用した時点で打切りとした感度解析を行った結果、主解析の結果と同様の結果でした。
また、主要評価項目の結果に加えて、無作為化後14 日時点及び28 日時点での亡くなった割合、無作為化後14 日時点でのNIAID-OS に基づく臨床状態、並びに亡くなるまでの期間についても、
プラセボ群と比較して本剤群で良好な傾向が認められていることから、本剤の有効性は示されていると考察されています。
安全性
安全性については既存の薬剤ということで今回は省略させていただきます。
COVID-19の疾患特性と相まって、VTEについては注意が必要であり、対応方法含めて考察されていますが、今回は割愛しますね。
興味ある方は直接審査報告書なり、専門部会の議事録をご確認ください。
日本人での確認は必要か?
今日もう一つ取り上げたいのは、安全性ではなく、日本人での確認についてです。
ACTT-2 は国際共同治験であり、日本も参画していると述べましたが、実は当該試験に組み入れられた日本人患者はプラセボ群の1例)のみだったのです。
これでは「日本人で試験していないものと同義」です。
この点について、どのように考えればよいのでしょうか?
申請したリリーの見解をまとめました。
・SARS-CoV-2 による感染症について、国・地域により10 万人あたりの感染者数及び亡くなった人の数には差が認められるものの(World Health Organization;WHO Coronavirus Disease (COVID-19) Dashboard))、
SARSCoV-2 による感染症患者において認められる諸症状、重症化のリスク因子等に国・地域による明らかな違いは認められていない(診療の手引き検討委員会; 新型コロナウイルス感染症(COVID-19)診療の手引き第 4.2 版、National Institutes of Health; Coronavirus Disease 2019 (COVID-19) Treatment Guidelines)。
・ACTT-2 試験に参加した国・地域において、SARS-CoV-2 による感染症患者に対して重症度に応じ酸素吸入、人工呼吸、ECMO による管理が行われ、薬物治療としてレムデシビルや副腎皮質ステロイド剤)等の投与が行われており、加えて血栓症対策や合併症管理が実施されていることから、国・地域によりSARS-CoV-2 による感染症の治療方針に著しい違いはないと考えられる。
・健康被験者、RA 患者、AD 患者等において本剤投与時のPK が検討され、本剤のPK に影響を及ぼす可能性のある内因性要因として特定されているのは腎機能のみであり、
日本人と外国人との間でRA 及びAD に対する本剤の有効性及び安全性に影響を及ぼす可能性のある明らかな民族差は認められていない(オルミエント審査報告書〔初回申請時〕、オルミエント審査報告書〔効能追加時〕参照)。
・本剤は RA 及びAD に対して承認されており、いずれの疾患についても主な臨床試験は日本を含む国際共同治験として実施され、日本人集団と全体集団における有効性及び安全性に明らかな違いがないことが確認されている(オルミエント審査報告書〔初回申請時〕、オルミエント審査報告書〔効能追加時〕参照)。
以上をもって、日本人での検討がなくても大丈夫!というのが企業側の見解です。
ちなみに何で日本人の組み入れがたったの1例だったのか?という点ですが、
ACTT-2 試験の患者組入れ期間中(2020 年5 月~6 月)における国内の新規診断患者数(平均約55 人/日))は減少傾向を示し、重症患者数も少なかったこと等により、日本人患者の組入れが極めて限定的になったものと考えられております。
ちなみに小児試験も行われていませんが、それにもかかわらず小児に対して適応がある点についても理由がありますが、今回の記事では冗長になりますので、割愛させていただきますね。
まとめ
今日はオルミエントの有効性を中心として、審査報告書を読み解いてみました。
少々難解な内容とはなりましたが、いかがでしたでしょうか?
オルミエントの概要や限定された適応についてご理解頂けましたか?
本記事を通して、COVID-19の治療薬の開発や結果を出すことの難しさを少しでも感じていただけたならば嬉しいです。
特効薬なんてものは、そうそう簡単に作れるものではないのです。









