
レムデシビルの特例承認で医薬品業界も世間も大騒ぎしています。
数日で承認できるなら、今まで規制当局は何をやってきたんだ?今後もそうすればいいじゃないか?と思われる方もたくさんおられると思います。
「臨床試験の在り方」や「レムデシビルが特例承認されるべきか否か」といった議論は置いておいたとして、この「承認に関わるプロセスに関する信用の失墜」が今回の特例承認の副作用として、非常に大きいのではないかと個人的には危惧しております。
特に医薬品開発に携わる方達は同じような危機感を持たれている方もおられるのではないでしょうか。
そこで今日は啓発も兼ねて、医薬品の承認申請から薬価収載されて販売開始するまでの「一般的な」流れについて、簡単に見ていきたいと思います。
流れといってもそれぞれのプロセスの詳細を見ていくわけではなく、今日はあくまで俯瞰するだけに留めます。
私はPMDAには所属しているわけではなく、開発担当者としてもぺーぺーですので、それぞれのプロセスでどのような議論がなされているのか、なぜそんなに時間がかかるのかを全て把握しているわけではありませんが、大まかな流れは掴めるかなと思います。
歯が立たない内容に深入りすると歯が欠けてしまいますからね。(私の)
Contents
医薬品開発の大きな流れ

上記に医薬品開発の大きな流れを示しました。
基礎研究にて医薬品のタマゴとなる候補化合物が作り出され、試験管内の試験や動物実験といった非臨床試験が行われ、ヒトへと投与する臨床試験に移ります。
臨床試験の中にもP1~P3(フェイズ〇、第〇相等とも言われますね)がありますが、こちらはまた別の機会にご説明しましょう。
ともかく臨床試験をクリアすると、それまでの全てのデータを規制当局に提出し、医薬品としての有効性や安全性を審査してもらいます。
これが承認申請のプロセスになります。
今日はこの「承認申請~製造販売まで」の流れ、上図のピンクの部分について見ていこうというわけです。
医薬品の申請区分や先駆け審査指定といった制度により、必要な工程や期間は変わってきますが、今日は一般的な医療用医薬品の新有効成分含有医薬品について考えていこうと思います。
医薬品の承認申請に必要な資料
医薬品の承認申請に必要な資料として下記のようなものがあります。
1. 起源又は発見の経緯及び外国における使用状況等に関する資料
2. 製造方法並びに規格及び試験方法等に関する資料
3. 安定性に関する資料
4. 薬理作用に関する資料
5. 吸収、分布、代謝、排泄に関する資料
6. 急性毒性、亜急性毒性、慢性毒性、催奇形性その他の毒性に
関する資料
7. 臨床試験の成績に関する資料
臨床試験の成績だけではなく、これまで経てきた過程が全て提出されるイメージですね。
現在はメインは電子化されていますが、過去に紙で申請していた時代(ついこの前まで)はトラック1台分になることもざらでした。
承認審査に時間がかかるのも、ちょっとわかる気がしませんか?
裏を返せば、今回のレムデシビルはいったい何をそんなに短期間で審査したのだろうか?とも思いますね。
これらの資料の形式は、 ICHで合意されたコモンテクニカルドキュメント (CTD)というものが使用されます。
要は世界で標準となる「箱」を用意することで、各国の規制当局間の情報交換を容易にしたり、製薬会社と規制当局間のコミュニケーションを円滑にしようというわけですね。
ありていに言えば、テンプレートと言っても差し支えないかと思います。
医薬品の承認審査の概略図
参考:承認審査業務(申請・審査等) | 独立行政法人 医薬品医療機器総合機構
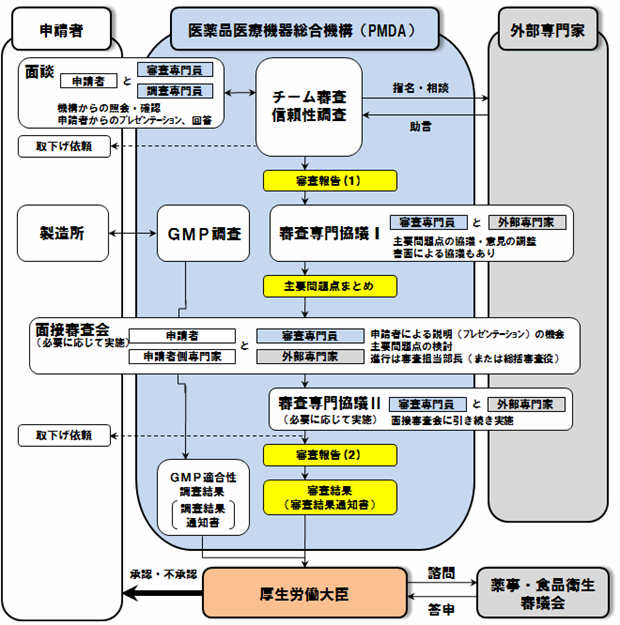
こちらはPMDAのホームページから引用した、医薬品の承認申請のフローチャートです。
何だかごちゃごちゃしてよく分かりませんか?
簡単にまとめると次の3つの柱があります
- 提出された申請資料の内容が倫理的かつ科学的に信頼できるかどうかを調査する「信頼性調査」
- 申請された製品の効果や副作用、品質について現在の科学技術水準に基づき、審査を行う「承認審査」
- 申請された製品を製造できる能力を有するかどうかを調査する「GMP/QMS/GCTP調査」
要は「データは信頼できる?」「有効性や安全性は大丈夫?」「その薬ちゃんと作れる?供給体制大丈夫?」って感じですね。
あまりデフォルメするとPMDAになめてるでしょ?って怒られるかもしれません。
承認審査の標準的プロセスにおけるタイムライン
参考:新医薬品に係る承認審査の標準的プロセスにおけるタイムライン | 独立行政法人 医薬品医療機器総合機構
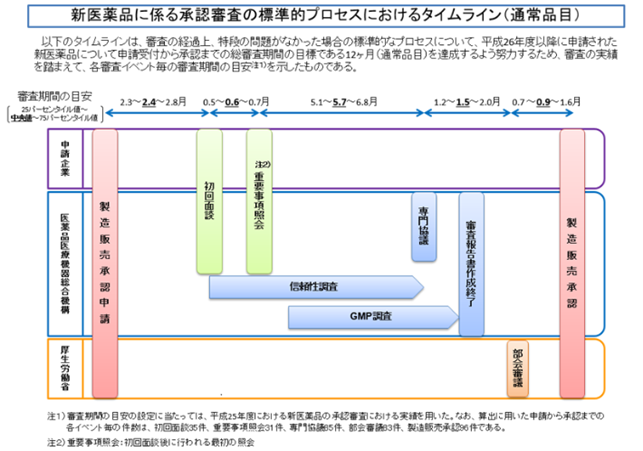
こちらもPMDAのホームページから引用してきた図になります。
ちょっとぼやけちゃったのでリンク先からご覧ください。
医薬品の承認申請プロセスにおいて、どこにどれくらいの時間がかかるのかが分かるかと思います。
通常はこの流れの通り、約1年近くかかることがざらです。
先駆け審査指定制度でも半年はかかります。
特に時間がかかるのが、真ん中部分の信頼性調査ですね。
この部分においては私もそこそこ経験がありますので、次で簡単に解説します。
審査におけるポイント
なおこの審査におけるポイントは下記のとおりとされています。
※新医薬品承認審査業務に係る審査員のための留意事項より抜粋
①実施された試験や提出された資料の信頼性が保たれているか。
②適切にデザインされた臨床試験結果から、対象集団における
有効性がプラセボよりも優れているか。
③得られた結果に臨床的意義があるか。
④ベネフィットと比較して許容できないリスクが認められていないか。
⑤品質確保の観点から、一定の有効性、安全性を有する医薬品を恒常的に供給可能であるか。
信頼性調査
信頼性調査とは提出された申請資料の内容が倫理的かつ科学的に信頼できるかどうかを調査することですね。
次にあげるGCP実地調査と書面調査というものがあります。
(これが実にやっかいなのです)
GCP実地調査とは?
治験が被験者の人権、安全、福祉の向上を図り、治験実施計画書を遵守して実施され、科学的な質と成績の信頼性が確保されているか検証することです。
GCP省令という省令に基づいて実施されます。
これはPMDAの担当者が試験に参加した複数の施設に実際に訪問して、丸1日かけて実施します。
そのための準備やアポイント調整等にも時間がかかる業務ですね。
ただこの部分において、施設を絞ったり、種々の調整や準備期間を短縮することは十分可能と思います。
それでもこの部分は治験のデータの信頼性や被験者の人権・安全が守られているかを確認する重要なプロセスなので、時間がかかってしまうことはある程度仕方がないと思います。
治験実施計画書からの逸脱事項はなぜ起きたのか、CAPAはどうなっているのか、同意説明のプロセスは適切か、この有害事象はなぜ因果関係なしと判断したのか、治験における患者さんの流れはどうか?などなど様々な観点で質問攻めにあいます。
書面調査とは?
CTDの根拠となる試験が、GLP、GCP、適切な試験計画書に従い、倫理的、科学的に適切に実施されているか、
また、「申請資料の信頼性の基準」に従って、適切かつ正確に承認申請資料が作成されているかどうかを、
根拠となった資料に基づいて、書面により調査・確認することです。
我々医薬品開発担当者がその場に立ち会って、あれこれ聞かれます。
その度にモニタリング報告書等を引っ張り出して、PMDAと何とか戦うわけです。
どうかお手柔らかに。
まあ戦うわけではなく、向こうはちゃんとできているか「確認している」だけなのですけどね
しかし実に紳士的に的確に痛いところをついてきます。
PMDAはきっとみんなSなのです。
握手しながら足をぐりっと踏んでくるのです。
薄氷の上で社交ダンスしているような危うい場面もあります。そろそろやばい
ここで万が一クリティカルな事項があると大変なことになります。
そうならないように普段の業務は当然として、書面調査のためにも色々と対策と準備を行うのです。
承認審査
承認審査の内容は審査報告書を読んでみるのが一番です。
私の記事の中でも2つ取り上げていますので、雰囲気はそちらでつかんで頂ければと思います。
私はこれを読むのが趣味の一つです。
・アビガン
【COVID-19】アビガンの審査報告書を読んで、催奇形性の副作用について考えよう!【コロナ】 – るなの株と医療ニュースメモ
・ヒドロキシクロロキン
【COVID-19】ヒドロキシクロロキンの心血管系の副作用について考えよう!【審査報告書】 – るなの株と医療ニュースメモ
GMP/QMS/GCTP調査
いわゆる医薬品の製造部分を確認するわけですが、この部分についての詳細は今回は割愛させて頂きます。
私の専門範囲外ということもあり、取り上げる際は改めて勉強させて頂きます。
薬価収載、保険適用までの期間
参考:医療用医薬品の薬価基準収載等に係る取扱いについて
さて無事承認されたとしてもそれで終わりではありません。
薬価収載、保険適応が必要なのです。
これまでの日本の制度ではほぼ承認取得すれば薬価収載される形でしたが、近年は費用対効果の議論(HTA:医療技術評価)があり、この辺りは変わっていくかもしれませんね。
何度か話題に上げて、解説するとしていましたが、いずれちゃんとまとめます。
非常に面白い分野です。
話を戻しまして、新医薬品の薬価基準収載が施行されるまでの標準的な事務処理期間は、当該新医薬品の承認から原則として60日以内、遅くとも90日以内とすると定められております。
つまり承認からだいたい2-3ヶ月で収載されるということです。
この薬価の審議には中医協の人々も絡んできます。
レムデシビルもすぐに審議されるようです。
この部分の詳細も今回は割愛しますね。
薬価基準収載品目の供給について
参考:医療用医薬品の薬価基準収載等に係る取扱いについて
新薬収載希望者は、その製造販売する医療用医薬品が薬価基準に収載された場合は、特にやむを得ない正当な理由がある場合を除き、その収載された日から3ヶ月以内に製造販売して、当該医薬品の医療機関等への供給を開始するとともに、継続して供給するものとするとの規定があります。
つまり薬価収載から3ヶ月以内には晴れて供給開始するというわけです。
まとめ
今日は医薬品の承認申請から製造販売開始までの一般的な流れについて簡単にまとめてみました。
結構色々なプロセスがありますよね!
今回レムデシビルが突風のように承認をかっさらっていったわけですが、これらのプロセスを無視してよいわけがありません。
いずれ後付けで審査が行われるのではないかと考えています。
そこで何かクリティカルなことが見つからないことを祈るばかりです。
ともあれ、承認申請って結構大変なんだなーって少しでも思って頂ければ、私としてはこの記事の価値があったと考えます。
レムデシビルを否定する気はないのですが、今一度レムデシビルの特例承認についても、思いを巡らせていただけますと幸いです。
きっとそれが医薬品の承認申請プロセスに対する理解と信頼の回復につながると信じています。
※当ブログにおける見解は個人的見解であり、所属する企業の見解ではございません。また特定の銘柄の購入を推奨するものではありません。PMDAは優しくしてください。







